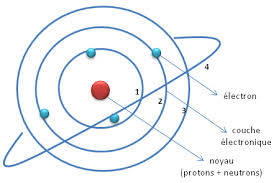
Le modèle de Bohr de l'atome d'hydrogène est basé sur le modèle planétaire, mais Bohr ajouta une hypothèse concernant les électrons. Et si la structure électronique de l'atome était en fait quantifiée ? Bohr supposa que les électrons ne pouvaient tourner autour du noyau que sur des orbites ou couches spécifiques de rayon de courbure constant. Dans les décennies qui ont suivi, les travaux de scientifiques comme Erwin Schrödinger prouvèrent que les électrons se comportaient à la fois comme des ondes et comme des particules. Le principe d'incertitude contredit l'hypothèse de Bohr selon laquelle les électrons évoluent sur des orbites spécifiques, avec une vitesse et un rayon orbital connus. À la place, on ne peut que calculer des probabilités de trouver l'électron dans une certaine région de l'espace autour du noyau.
- Enseignant: Mohamed Amine Ferhat (Enseignant)